スポンサーリンク
分散力
非極性分子間の分子間相互作用は極性分子に比べるととても小さなものです。
この原理は量子力学を使って解明され、Londonの分散力と呼ばれています。
この力は運動している電子と原子核の相互作用が時間平均化されて現れる現象で非極性分子に限らずあらゆる分子で働いています。
(教科書によってはこの分散力をvan der Waals相互作用と同義としているものもありますがIUPACでは分散力+双極子間相互作用と勧告しています)
分散力の基原は分子の電荷の揺らぎが瞬間的にもたらす双極子モーメントが周囲に電場を形成して近くにいる分子の双極子モーメントを誘起することにあります。
この分子間相互作用のポテンシャルエネルギーが分子間距離rによってどのように変化するかを表す経験的モデル式がLennard-joesポテンシャルです。
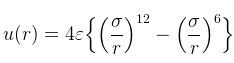
εやσは分子に固有の定数です。
12次の項は分子間に働く反発力を表し、この力は主にパウリの排他律に基づいています。
6次の項は引力を表しており2つの分子間の分散力に依存しています。
分散力は2つの分子に属する電子が極めて近い距離に来たときにのみ働くので、分子同士の接触面積が大きいほど大きくなります。
よって同じ分子量の構造異性体では直鎖の分子の方が球形に近くなる分枝の多い構造体よりも相互作用が大きくなり、その結果沸点が高くなります。
まとめ
分散力=あらゆる分子間で働いている電子と原子核の相互作用
働く力の大きさの序列は、水素結合>ファンデルワールス力>双極子間相互作用>分散力



