医薬品リスク管理計画 (Risk Management Plan:RMP)は、100回で初めて登場してから104回までに合計4回登場しています。
医薬品リスク管理計画(RMP)は、2013年4月以降に製造販売承認申請される新医薬品とバイオ後続品、2013年4月以降に新たな安全性の懸念が判明した既承認の品目に策定が義務付けられました。
新しい制度ですが、シンポジウムや勉強会などで取り上げられている話題です。
近年の出題頻度から考えると押さえておきたい単語だと思います。
スポンサーリンク
薬剤師国家試験の押さえておきたい「医薬品リスク管理計画(RMP)」の出題ポイント!
ポイント①RMPの目的とは?
医薬品のリスク(副作用)を最小化するため
「開発」「審査」「市販後」の全て情報まとまったものがRMPです。
添付文書は主に治験や市販後の情報だけですが、RMPには添付文書の情報を含むより詳細な情報が記載されています。
「PMDA 3分でわかる!RMP講座より引用」
つまりその薬が誕生して患者さんに使った後までのデータを詰め込んだものがRMPです。
ポイント②RMPの構成は?
「PMDA 3分でわかる!RMP講座より引用」
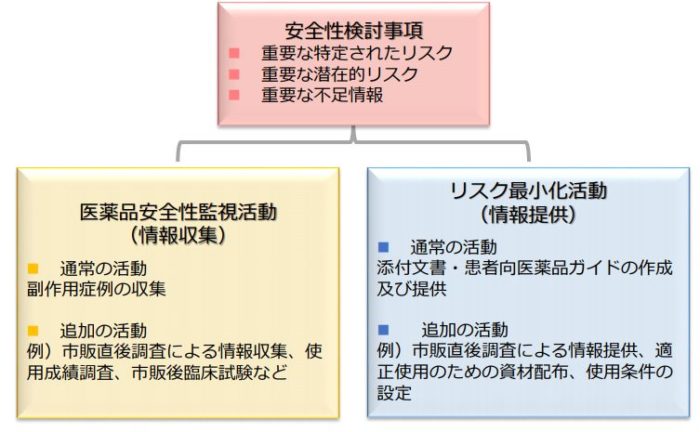
医薬品リスク管理計画(RMP)は、大きく「安全性検討事項」「医薬品安全性監視活動」「リスク最小化活動」の3つから構成されます。
そのため、薬剤師国家試験では「安全性検討事項は何が含まれるか?」、「添付文書はどこに含まれるか?」などの形式で出題されます。
「医薬品安全性監視活動」、「リスク最小化活動」は、使用成績調査や添付文書など具体的な資料が記載されているためイメージしやすいと思います。
しかし、安全性検討事項の3つに関しては、具体的にどういった内容かイメージできないのではないかと思います。ぜひ下記の資料を参考にしてください。
「PMDA 医薬品・医療機器等安全性情報No.300より引用」
ポイント③どの薬が対象となるのか?
冒頭で説明したように、
・「2013年(平成25年)4月以降に製造販売承認申請される新医薬品」
・「バイオ後続品」
・「2013年(平成25年)4月以降に新たな安全性の懸念が判明した既承認の品目」
に策定が義務付けられています。
3つ目の「2013年(平成25年)4月以降に新たな安全性の懸念が判明した既承認の品目」などは、ひっかけ問題として出題される可能性があるので、覚えておきましょう。
過去問を解いてみよう!
100回 問190
医薬品リスク管理計画 (Risk Management Plan:RMP) に関する記述のうち、正しいのはどれか。2つ選べ
1 RMP は、治験の第三相試験を開始するまでに策定しなければならない。
2 安全性検討事項は、重要な特定されたリスク、重要な潜在的リスク、重要な不足情報に分類される。
3 市販直後調査は、医薬品安全性監視計画に含まれる。
4 添付文書の作成や改訂は、リスク最小化計画には含まれない。
5 バイオ後続品については、RMPを策定しなくてもよい
解 2,3
選択肢1はペンが止まるところですが策定を検討するのは、「承認申請」または「製造販売後で新たに安全性の懸念が判明した」タイミングです。
RMPは安全に医薬品を使用するためのものですので、製造販売の承認申請の前に策定をする必要はありません。